流动相pH的科学选择-液相方法开发必须了解!发表时间:2022-02-28 12:00 适用范围 本思路仅适用于反向色谱法分析离子化合物方法开发中流动相pH的确定。 考察离子化合物的pKa值 pKa:酸式解离常数Ka的负对数,即 : 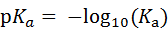 pKa越小,酸性越强;反之,酸性越弱。pKa的大小和化合物本身的结构有关,也和溶剂有关,比如在水中测到的pKa和在DMSO中测到的就不一样。 既然pKa很重要,我们怎么才能获得分析物的pKa值呢? 第一,对于已知化合物,我们可以通过一些数据库进行查询。在这里比较推荐两个开放的数据库,一个是英国RSC的www.chemspider.com,这是一个通用型的数据库,收录的化合物类型也比较广;另一个是针对于药物分子数据的加拿大数据库www.drugbank.ca,只要输入目标化合物的CAS号或者英文名,就很可能可以在这两个数据库上查到相关信息。 假如我们没办法在数据库中查到相关信息,我们可以根据一些已知数据进行预测。这就是一个比较系统的工程,因为一般一个化合物的pKa除了与它的关键基团如羧基、氨基等有关,还和这些基团所连接的其他结构有关,因此最好以结构尽量类似的已知化合物的pKa为基础进行预测。下面摘取了《Modern Physical Organic Chemistry》中常见结构的酸碱化合物在水溶液中的pKa: 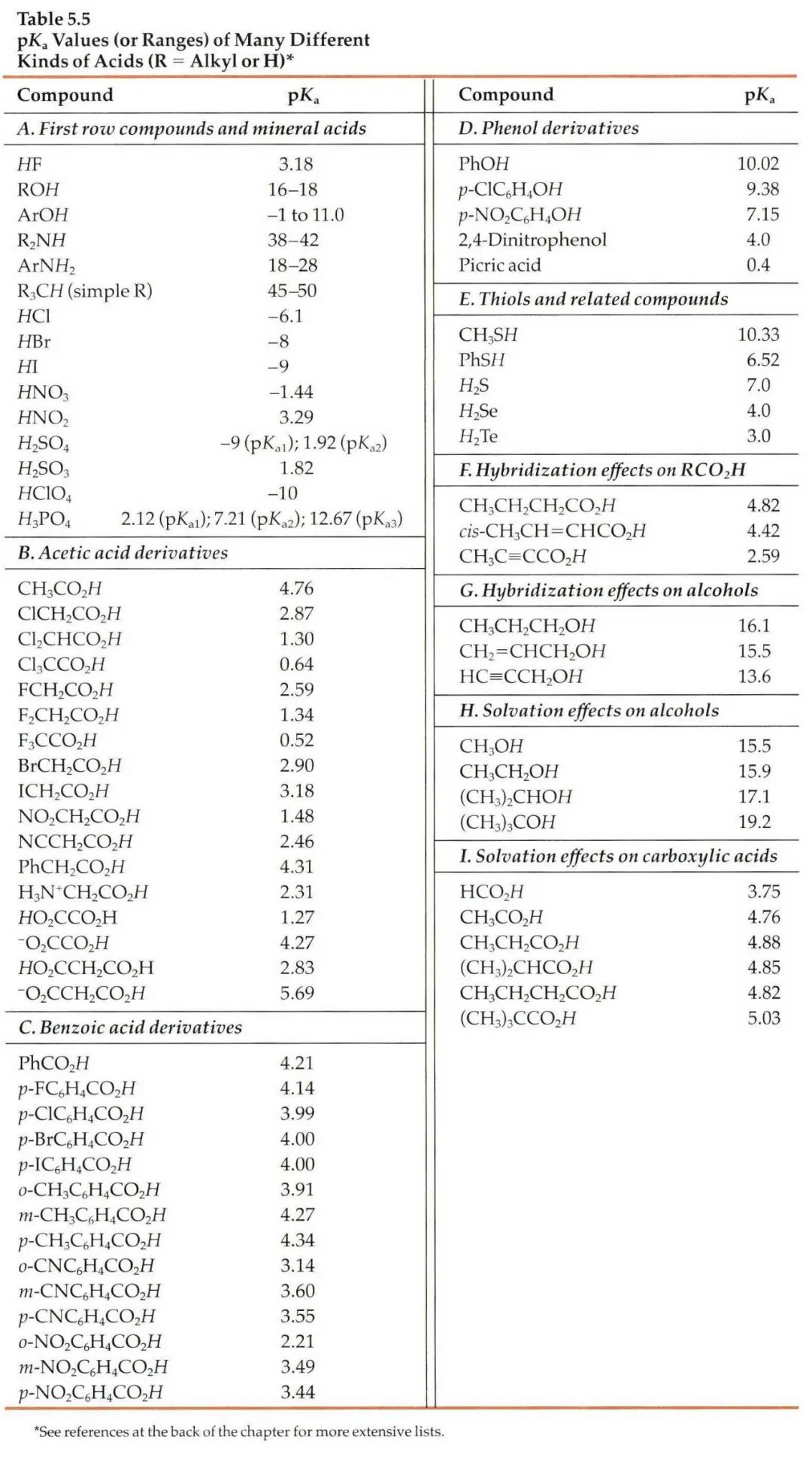  第二,在反相色谱分析中通常不要求化合物精确的pKa值,我们可以根据一些已知数据进行预测。对于一些典型的化学物,我们应该熟知它们的pKa。最常见的脂肪族羧酸pKa值约为5,比如布洛芬的pKa为5.2;典型的胺类化合物的pKa约为9,比如阿米替林的pKa是9.4。这样在分析一些酸碱性的问题时就可以信手拈来,方便快捷。根据化合物的结构按照下图中列出的主要酸碱官能团在水溶液的pKa值进行推测。 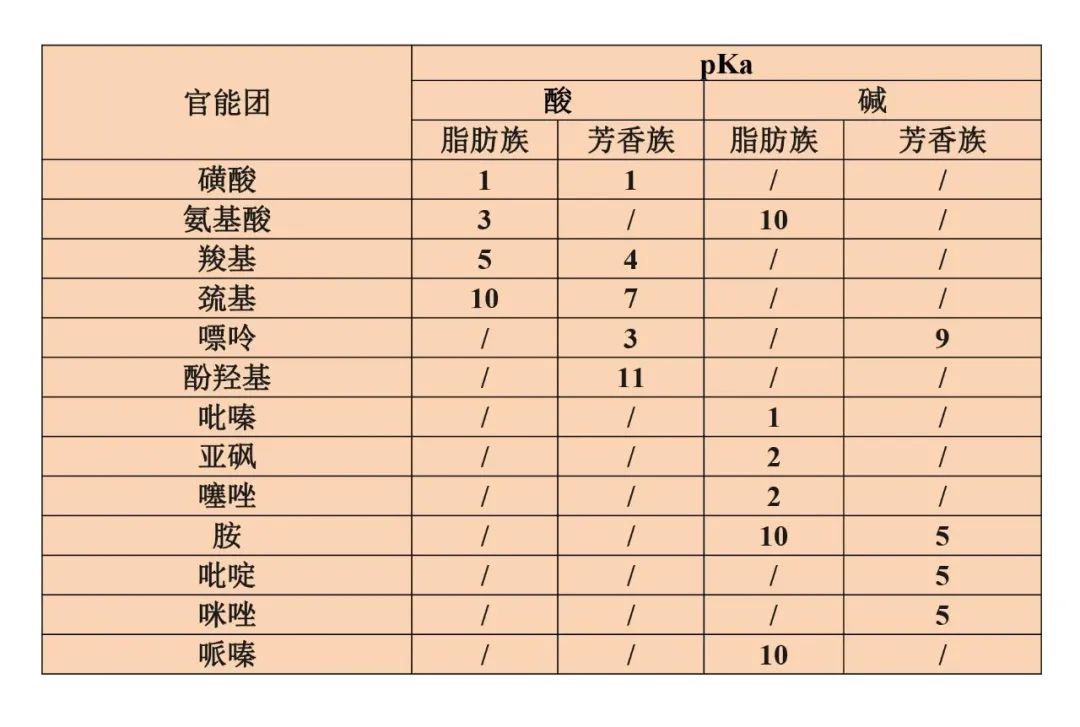 注意:按照上表中官能团进行估算时分子中相邻基团的不同会导致pKa出现1-2个单位的差异。对于酸性化合物,当含有吸电子基团时会导致酸性增强,pKa值相应降低;对于碱性化合物,当含有吸电子基团时会导致碱性降低,pKa值相应降低。 根据化合物pKa值推测流动相相应使用的pH 先看下流动相pH对酸碱化合物的影响: 1.流动相pH对不同pKa化合物的保留时间的影响 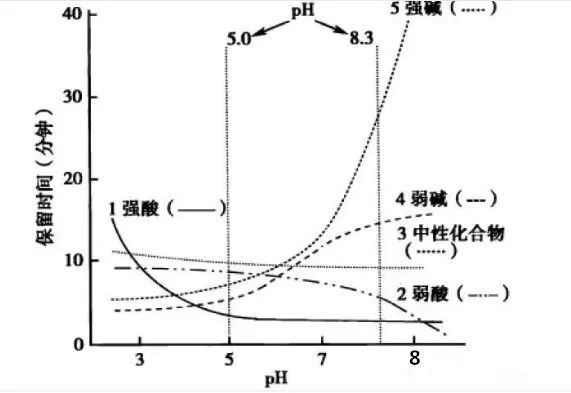 请仔细观察上图,通过该图我们可以获得以下信息: (1)调节流动相pH可改变离子化合物的保留 强酸及弱酸性化合物在酸性条件下会以分子形式存在,此时疏水性较高(极性大)在RPC的保留会较强。强碱及弱碱性化合物在碱性条件下多以分子形式存在,此时疏水性较高(极性大)在RPC的保留会较强。而中性化合物的保留基本与pH没有关系,不随pH的改变发生保留时间的变动。因此我们在方法开发的时候可以通过改变流动相的pH进行改变化合物的保留时间。 (2)如果是未知的化合物,调节pH值我们可以根据保留时间的变化推断化合物的酸碱性,比如保留时间随着pH的增大而延长的样品肯定是碱性化合物。 2.流动相pH对化合物峰型的影响 根据流动相pH对酸碱化合物的电离的影响,当化合物的pKa与流动相pH重合时会导致分子与离子形式共存,化合物的峰型不好。因此建议将pH控制在化合物的pKa±2的范围以外,此时化合物99%基本是以分子或者离子形式存在,峰型会更加的尖锐。 3.流动相pH对化合物的选择性的影响 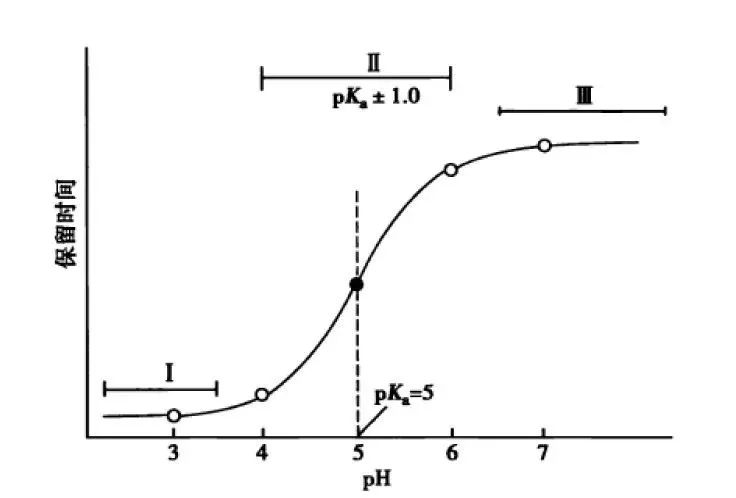 根据这幅图,我们可以看出,当流动相的pH约等于化合物的pKa时,可以最大限度的调整化合物的保留时间。此时改变0.1个单位的pH可以使得保留因子k变化10%,可引起分离度±2.5个单位的变动。但此时需要进行精确控制流动相的pH,这要求把流动相pH控制在0.02个单位以内,在实验室很难控制,重现性较差,成为分析的瓶颈。 但我们实验时可以将pH范围放宽,只要将流动相pH控制在化合物pKa值±1.5个单位的范围内(上图所示的II范围内)就可以对化合物保留行为产生比较明显的影响,此时进行分离选择性较好。同时为了更好地控制保留行为的重现性,需要控制缓冲液的pH在±0.1个单位以内(当流动相pH控制范围较窄时建议使用缓冲盐的质量进行控制,比pH计进行控制效果更优)。 通过以上三点分析我们可以得出,待分析化合物的pKa与确定流动相的pH有很大的关系。主要依据化合物出峰时间、化合物的峰型及所需要分离目标的化合物综合考虑来确定流动相的pH。 可能有的同事会发现第二点和第三点是有些矛盾的,这时候就需要对自己的实验进行初步的探索,看看是否pH值会对化合物的峰型产生影响(有的专家认为该观点缺乏理论和实践的支持)或者是否需要准确调节pH在化合物pKa±1.5范围内进行提高选择性。 笔者在做实验时发现有的物质会因稀释液pH使用不当产生峰分叉的现象,调节稀释液的pH即可解决峰的分叉;有时流动相pH在化合物的pKa±2的范围内时离子化合物并没有出现峰分叉、峰型不好现象。 根据流动相pH值测定所需要的缓冲盐 1.缓冲液选择主要依据: (1)缓冲溶液的pKa和缓冲容量 (2)溶解度 (3)紫外吸收 2.对以上三点进行说明 (1)一般缓冲溶液的pKa值与流动相的pH相等时缓冲能力最大,pKa与流动相的pH相差越大,缓冲液的缓冲能力越差。一般要求流动相的pH与缓冲液的pKa值不能超过±1.0个单位,当缓冲溶液浓度较高时可以放宽范围到1.5个单位。常用的缓冲液的缓冲范围见下图: 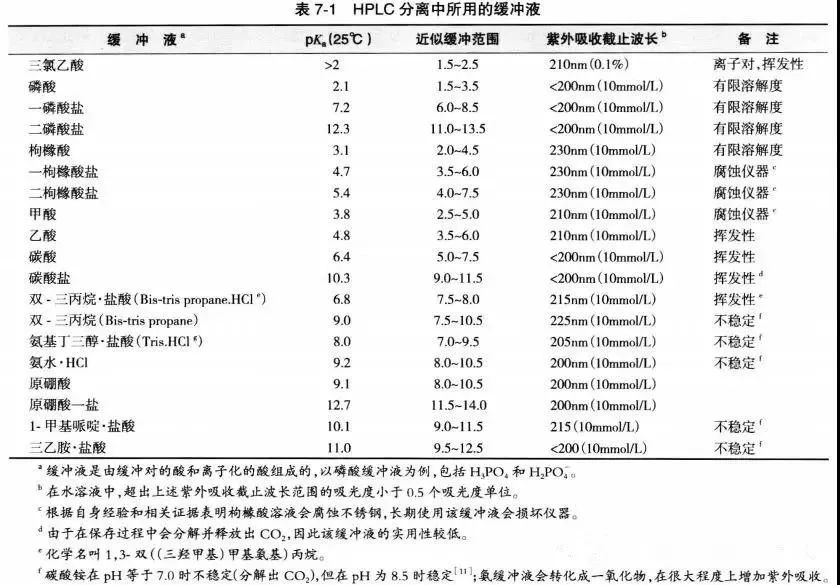 缓冲溶液的浓度一般在5-50mmol,因过低导致缓冲能力不足(可通过调整进样体积查看化合物峰型的变化,如果出现拖尾或者前沿现象,说明缓冲溶液的能力不足);缓冲液浓度过大会导致与有机相混溶时盐的析出,对仪器、色谱柱都会产生损伤,而且使得基线不好。一般初始摸索方法时推荐使用25mmol。 (2)根据缓冲液溶解度:在酸性缓冲溶液中,如磷酸盐,缓冲液溶解度顺序:钠盐<钾盐<铵盐;有研究发现,当pH=7时10mmol的磷酸钾在85%甲醇或者75%乙腈中可以溶解,在pH=3时,在85%甲醇或者85%乙腈中可以完全溶解(此测试通过使用容器将不同比例的混合溶剂进行混合,观察大约30min,是否有沉淀产生,否则就要降低缓冲液的浓度或者有机相的含量,在梯度洗脱时尤为注意)。 (3)根据化合物的吸收波长:在pH≤3.5,6.0≤pH≤8.5或者pH≥11.0磷酸盐缓冲液是不错的选择。而甲酸盐和乙酸盐缓冲液的范围是2.5~6.0,适用于210nm或者更高吸收的检测波长。 3. 缓冲盐的作用: 缓冲液的作用主要有两个方面: (1)缓冲分析物,使其保持在所需的pH值处。由于在实际分析工作中,色谱柱上的样品质量非常少,因此仅需要很少的缓冲液就能为样品提供足够的缓冲。如果样品与流动相的pH值相差大,且进样量太大,建议在进样前先调节样品溶液至接近流动相pH值。 (2)缓冲色谱柱,使其保持恒定的pH值。由于大量的缓冲流动相通过色谱柱,所以固定相不断暴露在缓冲液中。随着现在商品化的硅胶基质色谱柱纯度的提高,硅胶上的酸性硅醇基团的含量也越来越低,因此所需的缓冲液也越来越少。下图是高纯、中等纯和低纯硅胶的柱子在添加0.1%和增加0.01%TFA时分析图谱对比: 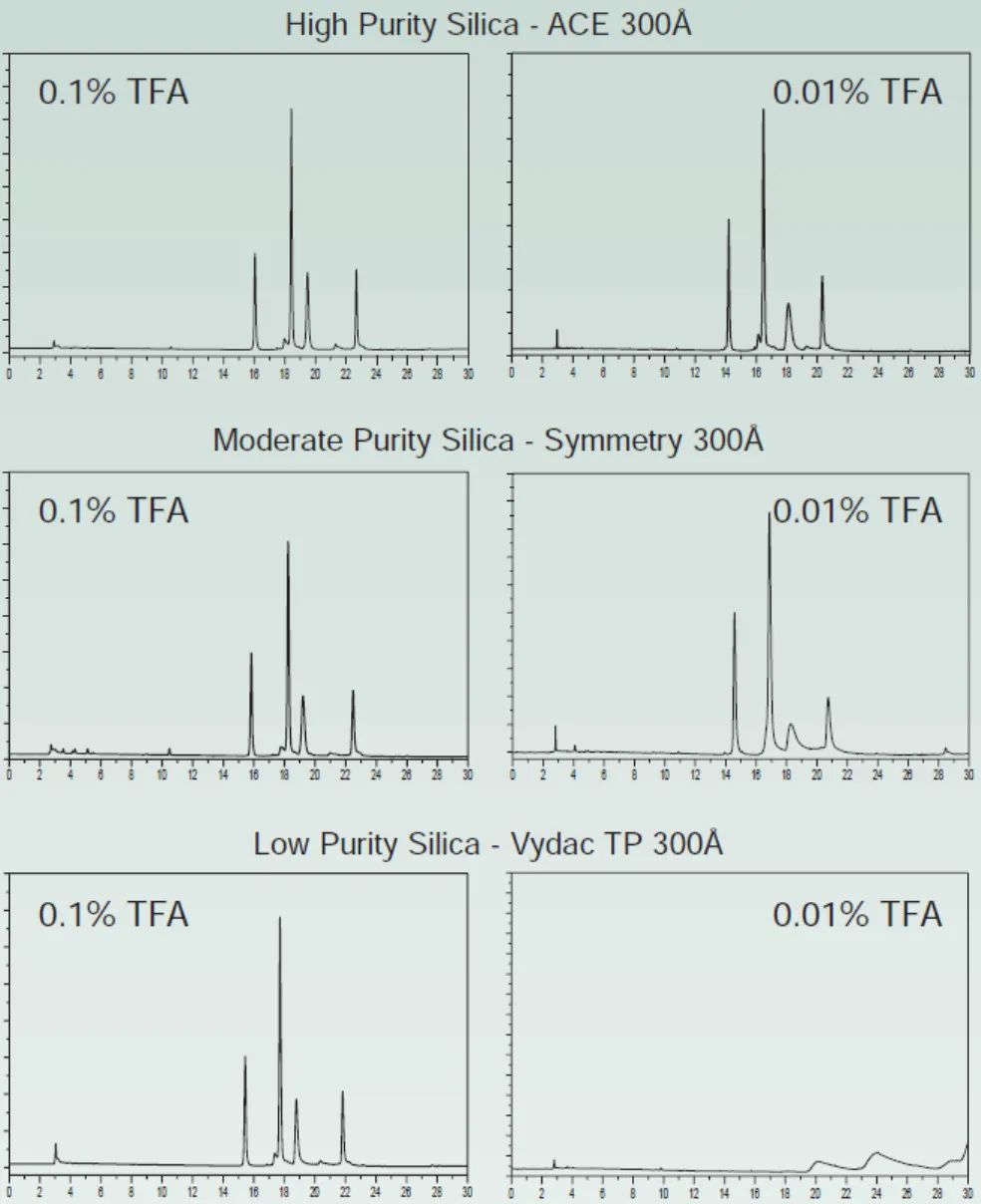 4. 常用缓冲盐点评 磷酸盐:是HPLC在紫外检测条件下最常用的缓冲液之一,因为它可以在低于220 nm的波长下使用。磷酸盐具有三个pKa值,可提供pH 1.1-3.1,6.2-8.2,11.3-13.3三个缓冲范围。虽然它使用广泛,但是也要注意它的溶解度问题,防止高浓度条件下在HPLC泵或者色谱柱中析出。 醋酸盐:也是HPLC在紫外检测条件下最常用的缓冲液之一,可以在高于220 nm的波长下使用。它可以提供pH 3.8-5.8的缓冲范围,因此它刚好填补了磷酸盐在pH 2.0-8.0之间的缺口。 因此磷酸盐和醋酸盐的配合使用可以满足通常用于硅胶基质色谱柱的整个pH范围。 三氟乙酸:0.1%的三氟乙酸能产生pH≈2的流动相,多年来它一直是低pH条件下LC-MS的首选添加剂,但是TFA能够抑制电离,导致信号下降。TFA也可作为离子对试剂,广泛用于蛋白和多肽类的分析。 甲酸:0.1%的甲酸能产生pH≈2.7的流动相,已经成为低pH条件下LC-MS的首选。 根据以上的理论,流动相缓冲容量取决于缓冲盐的pka,缓冲盐浓度,流动相pH。 当缓冲液中溶质的的两种形态(HA和 A-)浓度相等时,即缓冲盐的pka与流动相pH相等时,缓冲能力最大。当流动相的pH与缓冲盐的pka相差越大,缓冲盐的缓冲容量就越小。因此缓冲的pka与流动相的pH相差不能超过±1.0个单位。 流动相的缓冲容量一般与缓冲液浓度成正比关系,通常浓度范围为5~25mmol/l。 样品溶解在流动相中可以避免在反相色谱过程中发生缓冲能力的问题,尤其是流动相缓冲液浓度较低或注入样品量较大的时候尤为重要。 当缓冲容量偏低时,可以从以下方面调节缓冲容量: 1、减少缓冲液pKa与流动相pH之间的差异(可调节pH或更换缓冲液) 2、矿大流动相pH和溶质pKa之间的差异(当差异足够大时,溶质倍完全离子化或者保持非离子化形式此时缓冲液显的不重要了) 3、增加缓冲液浓度 4、减少样品进样体积 5、调节样品的pH与流动相的一致。 单位名称:武汉恒信世纪科技有限公司 电话: 027-68782170 |
